Pfizer pide autorización para distribuir su vacuna a la Unión Europea
Tras anuncio de Moderna, ahora es la vacuna desarrollada conjuntamente por Pfizer y BioNTech la que podría ser autorizada pronto en Europa. Logró una eficacia del 95% en el ensayo clínico de fase III
Por Canal26
Martes 1 de Diciembre de 2020 - 08:55
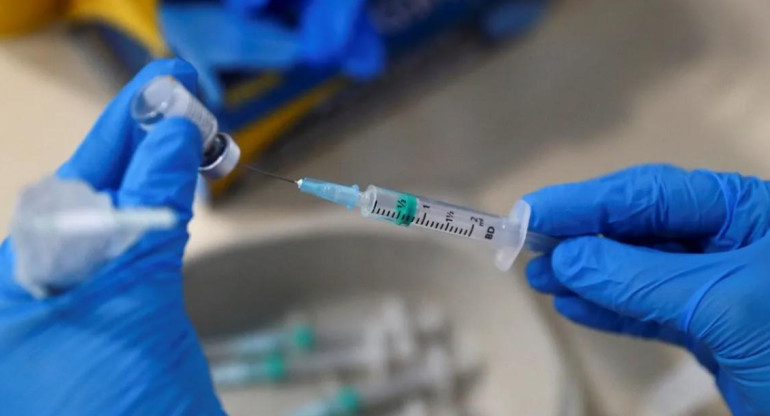
 Pfizer pide autorización para distribuir su vacuna a la Unión Europea. REUTERS.
Pfizer pide autorización para distribuir su vacuna a la Unión Europea. REUTERS.
Pfizer y BioNTech presentaron una solicitud ante la Agencia Europea del Medicamento para que autorice la comercialización condicional de su vacuna contra el coronavirus. La compañía se suma así a la solicitud que este lunes realizó Moderna, fabricante de otro de los propotipos más avanzados de vacuna frente a la Covid.
La farmacéutica ya había pedido el 20 de noviembre pasado al organismo equivalente en EEUU, la FDA, la autorización de emergencia para comenzar a distribuir su vacuna, convirtiéndose así en la primera en hacerlo.
"Para nosotros como empresa asentada en el corazón de Europa se trata de un hito importante, nos seguiremos esforzando por distribuir la vacuna en todo el mundo tras una posible autorización", declaró el presidente de BioNtech, Ugur Sahin.
La candidata a vacuna de la Covid-19 BNT162b2 -así se llama el compuesto mientras está en fase de investigación- ha logrado una eficacia del 95% en el ensayo clínico de fase III que tiene en marcha, según los resultados obtenidos a partir de 165 pacientes.
El antígeno, que la compañía americana está desarrollando junto a BioNTech, ha logrado completar todos los objetivos primarios de eficacia, tanto en pacientes sin infección previa por coronavirus como en pacientes con infección previa.
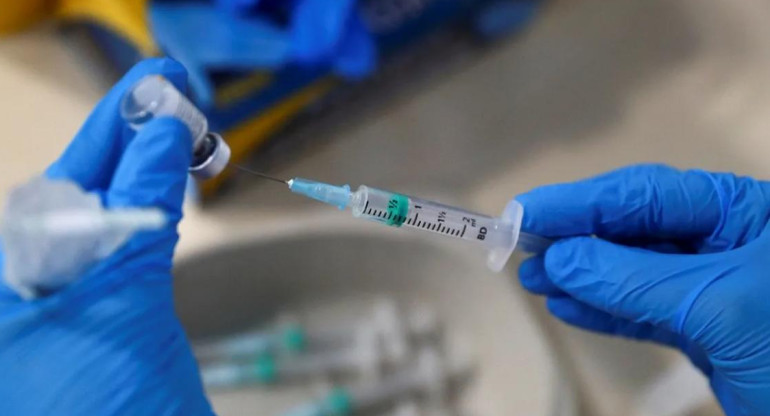
 Pfizer pide autorización para distribuir su vacuna a la Unión Europea. REUTERS.
Pfizer pide autorización para distribuir su vacuna a la Unión Europea. REUTERS.
De hecho, el antígeno ha logrado una eficacia "constante según la edad, el género, la raza y la etnia. La eficacia observada en adultos mayores de 65 años fue superior al 94%", asegura Pfizer.
En cuanto haya eficacia contrastada y material suficiente fabricado, la Unión Europea recibirá unos 300 millones de vacunas. El reparto de las dosis se hará de forma proporcional y por población, como ya se anunció que ocurriría en el caso del antígeno de AstraZeneca.
"En caso de que la EMA (Agencia Europea del Medicamento) llegue a la conclusión de que las ventajas de la vacuna contra el coronavirus son superiores a los posibles riesgos, el organismo recomendará una salida al mercado condicionada", estiman las empresas en su comunicado sobre la decisión que esperan.
Ya hace una semana Pfizer y BioNtech habían solicitado una autorización de urgencia para su vacuna ante las autoridades sanitarias de EEUU, donde el organismo competente (la Administración de Alimentos y Fármacos, FDA, en inglés) se reunirá el 10 de diciembre para decidir sobre la solicitud.
La EMA ya ha iniciado un procedimiento especial para acelerar la autorización; en el proceso para obtener esta vía, los fabricantes de vacunas pueden, antes de presentar la solicitud completa, adelantar datos sobre la eficacia de la vacuna y su seguridad en relación con sus efectos secundarios.
En caso de que esos datos sean suficientes se puede otorgar una autorización condicionada.
La distribución y aplicación de la vacuna implicará un reto logístico ya que tiene que conservarse a una temperatura de menos 70 grados centígrados y para poder garantizarlas Pfizer y BionTech han desarrollado un sistema de transporte con sus propios refrigeradores.
Antes de conocerse el anuncio de las empresas, la ministra alemana de Investigación, Anja Karliczek, indicó que "se van a necesitar vacunas de distintos laboratorios" y advirtió de que en el proceso de autorización se trata no solo de evaluar su efectividad, sino también de que no presentará efectos secundarios adversos, que serán seguras y accesibles para todo el mundo.
Más Leídas
-
1
Trenes Argentinos: a quiénes les corresponde el pasaje gratis en los recorridos de larga distancia

-
2
Descubren una sorprendente pirámide antigua sumergida en las profundidades del océano

-
3
Jubilados y pensionados: cómo quedó el cronograma de pago de haberes modificado para mayo

-
4
Llega el descanso: cuándo son las vacaciones de invierno 2024 en cada provincia

-
5
Video estremecedor: un periodista reveló al aire que su padre y su tío abusaron sexualmente de él y sus hermanos

Suscribite a nuestro newsletter
Mantenete siempre informado
Notas relacionadas
También podría interesarte

Antony Blinken desligó a EE.UU. del ataque de Israel contra Irán: "No estamos implicado en operaciones ofensivas"