Brasil rechazó el pedido para evaluar uso de emergencia de la vacuna Sputnik V contra coronavirus
El veto corrió por cuenta y cargo de la Agencia Nacional de Vigilancia Sanitaria. Es por falta de estudios clínicos sobre la fase tres de la vacuna rusa.
Por Canal26
Domingo 17 de Enero de 2021 - 17:12
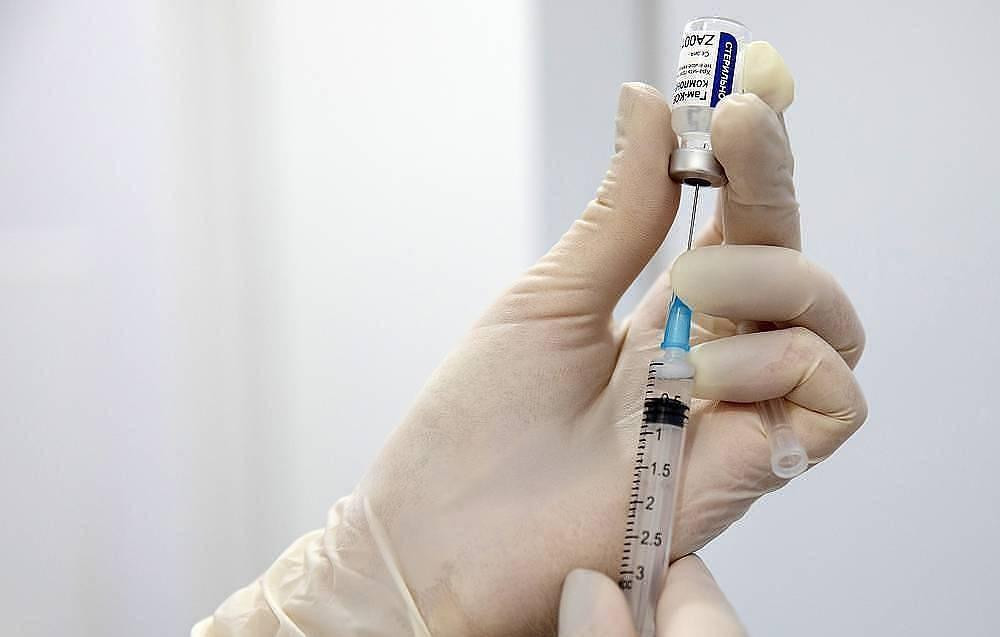 Vacuna rusa Sputnik V contra coronavirus. Foto: NA.
Vacuna rusa Sputnik V contra coronavirus. Foto: NA.
La Agencia Nacional de Vigilancia Sanitaria de Brasil (Anvisa) ha rechazado de plano el pedido por autorización de emergencia de la vacuna rusa Sputnik V contra el coronavirus, según un comunicado publicado por el organismo.
De acuerdo a lo que se puede leer en el texto, el motivo es que los documentos no presentaban “requisitos mínimos de presentación y análisis, y las cuestiones relacionadas con las buenas prácticas de fabricación”. La solicitud -finalmente vetada- para el uso de emergencia de 10 millones de dosis de la vacuna rusa fue presentada por la compañía farmacéutica União Química el viernes 15 de enero.
Anvisa ha mencionado a la falta de estudios clínicos respecto de la vacuna de fase tres. La agencia había determinado en los días pasado como uno de los criterios para la solicitud y la implementación de emergencia de la vacuna que el laboratorio lleve a cabo la fase tres de los estudios -la fase de análisis clínico- en Brasil.
Hasta el momento, el desarrollo ruso no comenzó esta etapa del proceso en territorio de Brasil. El organismo aclara que no basta con que la solicitud de autorización de la fase tres del ensayo clínico se presente para uso de emergencia. Es necesario que esos estudios estén en curso en el país.
De acuerdo al organismo, el pedido de autorización de uso de emergencia “debe incluir estrategias que el solicitante aplicará para garantizar que los ensayos clínicos en curso de la vacuna puedan evaluar la seguridad y la eficacia a largo plazo”.
União Química ha pedido de manera formal a Anvisa, a fines de diciembre, la autorización para dr inicio la fase tres de las pruebas de la Sputnik V, pero la solicitud aún no ha sido aprobada por la agencia porque se identificó que “faltan documentos”. Así pues, el 4 de enero, el Organismo pidió al laboratorio que presentara la información que faltaba y la complementaria. El 6 de enero, la compañía respondió que tan pronto como pueda cumplir con el requisito lo completaría. Pero, asegura el comunicado, “hasta ahora, Anvisa está esperando que la empresa cumpla con el requisito de completar el análisis de la solicitud de estudio”.
Entre tanto, el Fondo Ruso de Inversión Directa, desarollador de la Sputnik V, dijo al respecto que la información adicional solicitada por Brasil “será proporcionada en breve” y manifestó su confianza en que con ella se autorizará su producción en ese país. La vacuna rusa Sputnik V fue aprobada en Argentina, Venezuela, Bolivia, México , Paraguay, Egipto, Corea del Sur, India, Nepal, Bielorrusia, Kazajstán, Uzbekistán y Argelia.
Más Leídas
-
1
Preocupación para Petro: Colombia entró a la lista de países con inseguridad alimentaria aguda

-
2
El presidente de Irán advirtió que si Israel decide atacar su país, es poco probable que "quede algo del régimen sionista"

-
3
Escándalo de corrupción en Rusia: ya son tres detenidos por el caso del viceministro de Defensa

-
4
España: el denunciante de la esposa de Pedro Sánchez reveló que se basó en noticias de la prensa

-
5
Tremenda advertencia de la hermana de Kim Jong-un a Estados Unidos: "Seguiremos acumulando el poder militar más abrumador"

Suscribite a nuestro newsletter
Mantenete siempre informado
Notas relacionadas
También podría interesarte

Insólito cambio de opinión: luego de anunciar su salida del Barcelona, Xavi finalmente seguirá siendo el técnico

Aprender sobre inteligencia artificial desde casa: lanzan cursos gratuitos de programación y ChatGPT